Det foregår en kontinuerlig reparasjon av beinvevet i kroppen der skadet og gammelt beinvev byttes ut med nytt bein. Dette kalles remodelleringsprosessen. Denne utføres av to ulike celletyper; Osteoklaster som resorberer bein, og osteoblaster som danner nytt bein.
Når man tenker på skjelettet, drifter tankene gjerne mot restene etter en død person. En kald, stiv og livløs struktur, rester etter et liv som var. En passiv kleshenger for muskulaturen som en gang var der. Dette forenklede synet er langt fra sannheten om skjelettets rolle i en levende organisme. Skjelettet et levende, dynamisk system. Et organ sammensatt av 206 ben som varierer i størrelse, form og funksjon, og som er i kontinuerlig forandring. Det er påvirket av fysiske belastninger og gjennomgår en livslang prosess med vedlikehold og reparasjon, kjent som remodelleringsprosessen. Forståelsen av denne prosessen er viktig for å forstå hvordan skjelettet reagerer på belasting, hvordan stressreaksjoner oppstår, og hvordan slike skader repareres.
I tillegg til remodellering foregår det også en prosess som kalles modellering. Dette er måten knoklene som ikke er lange vokser på, for eksempel bekkenet. Vi kommer tilbake til bein modellering helt til slutt i artikkelen, men først litt grunnleggende anatomi.
Anatomi
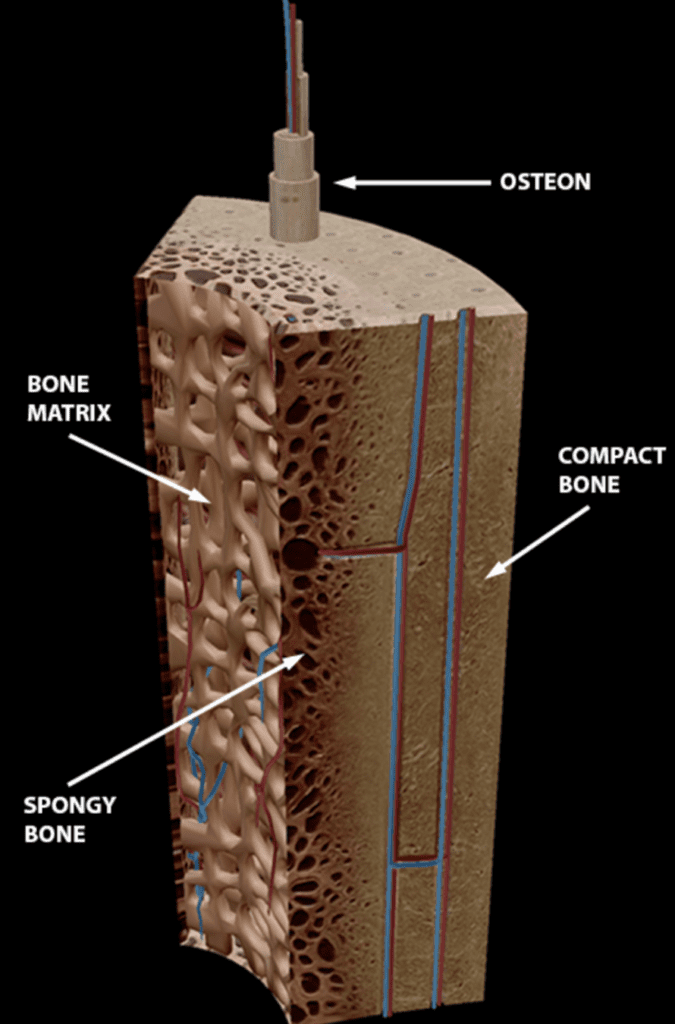
Alle ben i kroppen er dekket av en fibrøs hinne, som kalles periost. Under dette laget finnes det to hovedtyper av beinvev: kortikalt og trabekulært bein.
Det er stor variasjon i fordelingen av kortikalt og trabekulært bein mellom ulike knokler. Diafysen til lange rørknokler som for eksempel tibia har stor andel kortikalt bein. Korte og flate knokler, som for eksempel tarsalbeina og bekkenet, hovedsakelig består av trabekulært bein, som er omgitt av et tynnere lag av kortikalt bein.1
Kortikalt Bein
Kortikalt bein er tett og sterkt, og utgjør nesten 80% av den totale skjelettmassen. Denne typen beinvev er bygget opp av osteoner, som er sylinderformede strukturer organisert i lengderetningen av benet. Osteonene er tett pakket side om side. I midten av osteonet ligger en kanal, kjent som Havers kanal. Denne inneholder blodkar og nerver. Rundt denne kanalen er det lagdelt konsentriske lameller av mineralisert beinmatrix, nesten som årringene på et tre. Disse lamellene har kollagenfibre som løper parallelt innenfor hvert lag, men skifter retning mellom lagene for å skape en robust struktur.
Rundt lamellene finnes det små rom, lacunae, som hver huser en osteocytt, eller beincelle. Osteocyttene er forbundet med hverandre gjennom tynne kanaler kalt canaliculi, som muliggjør kommunikasjon og transport av næringsstoffer. Beinvevet er også utstyrt med Volkmanns kanaler, som transporterer blod tvers gjennom beinet og knytter de Haverske kanalene sammen med både periost og benmarg. Dette nettverket sørger for ernæring både til de ytre og indre delene av korteks, med næringsforsyning fra henholdsvis periost og beinmarg.1
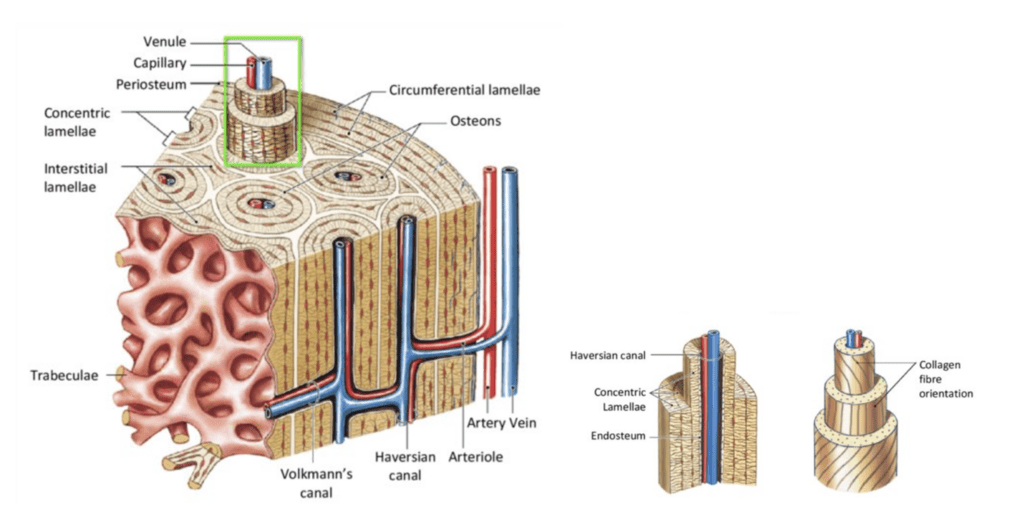
Trabekulært Bein
Trabekulært bein, består av trabekler som former plater eller bjelker omgitt av beinmarg. Volummessig utgjør denne typen av bein en betydelig del av skjelettet, selv om det representerer kun 20% av skjelettmassen. Trabeklene, som befinner seg under den kortikale overflaten, er strategisk organisert for å motstå belastninger. Dette resulterer i en struktur som er både lett og robust. På tross av sin mindre andel av skjelettmassen, har trabekulært bein høy metabolske aktivitet, som er fire ganger høyere enn i kortikalt bein.1
Trabekulært bein skiller seg fra kortikalt bein ved sin struktur. Det inneholder ikke osteoner, og derfor heller ikke Haverske eller Volkmanns kanaler. Arkitekturen gjør at blodkarene kan løpe fritt gjennom beinmargen som fyller rommene mellom trabeklene. Dette gir en mindre kompakt, men effektiv oppbygning. Trabeklene dannes gjennom en prosess hvor osteoblaster i periferien legger ned ny matrix, med konsentrisk avsetning av bein i lagvis lameller, som gradvis ossifiseres.1
Trabeklene er omsluttet av et endostealt lag som markerer grensen mot den omkringliggende beinmargen. Endosteum er rikt på blant annet stamceller, som har potensialet til å differensiere seg til ulike celletyper etter behov. Beinmargen, som utgjør over 75% av volumet i trabekulært bein, kan være enten rød og ansvarlig for produksjon av blodceller, eller gul og hovedsakelig bestå av fett.1
Skjelettet har dermed fire primære områder for remodellering: periostealt, endokortikalt, trabekulært, og intrakortikalt. Dette bidrar til skjelettets dynamiske natur, slik at det over tid kan tilpasse seg til blant annet endringer i belastning.
Remodelleringsprosessen og belastning
Beinvev er dynamisk og responderer kontinuerlig på de belastningene det blir utsatt for. Denne tilpasningsevnen er et resultat av en rekke faktorer som påvirker beinets turnover, inkludert hormonelle signaler, cytokiner og direkte mekaniske stimuli.
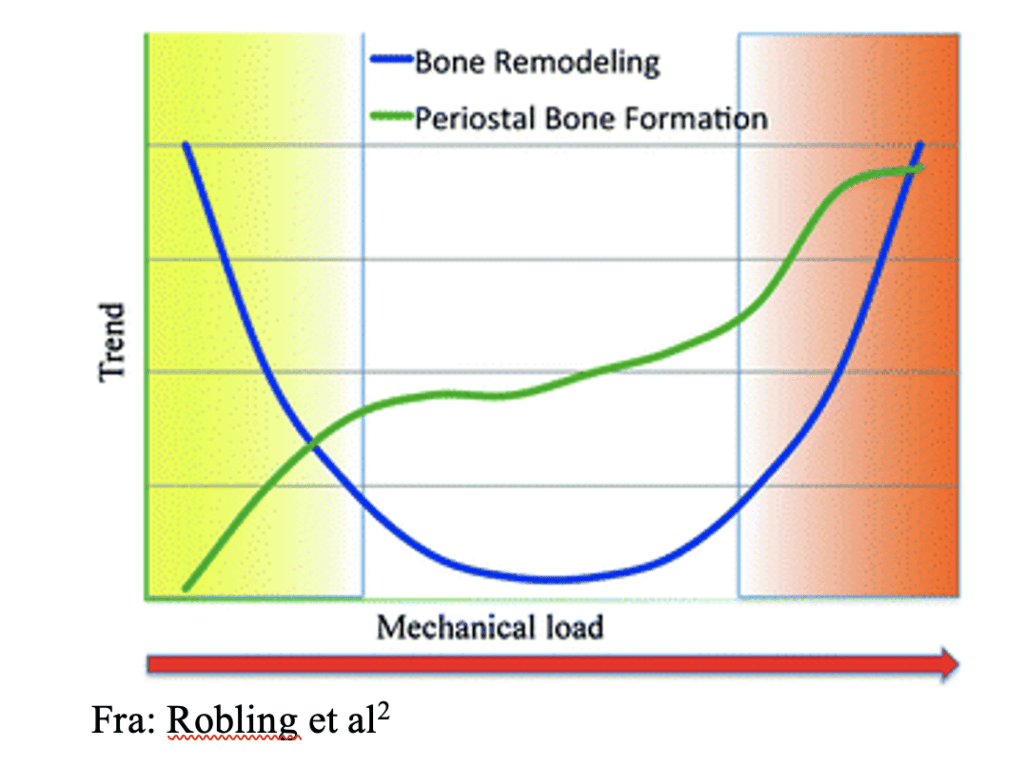
Mekanisk belastning har en distinkt innvirkning på beinremodelleringen, som kan illustreres gjennom en U-formet responskurve. Ved lavt nivå av fysisk aktivitet observerer vi en økt omsetning av beinvev, som ofte korrelerer med et tap av beinmasse. Høyere nivåer av mekanisk belastning vil føre til en økning i både remodellering og nydannelsen av beinvev, spesielt fra periostsiden.2 Dette fenomenet er spesielt relevant innen idrettsmedisin, hvor problematikken ofte ligger i det høyere spekteret av fysisk belastning. Det er imidlertid også viktig å vurdere skjelettets tilpasning etter perioder med redusert belastning, som for eksempel ved langvarig hvile eller inaktivitet. Når en utøver gjenopptar intensiv trening etter slike perioder, må tilpasningene og potensielle endringer i skjelettet tas i betraktning for å forebygge nye skader.
Beinets respons på fysisk belastning
Under fysisk aktivitet påvirkes skjelettet av komplekse krefter som inkluderer kompresjon, torsjon, bøyning, og skjærkrefter. Disse kreftene kan være resultatet av direkte kontakt med underlaget, drag fra muskler, eller en kombinasjon av begge. Effekten av disse kreftene på en spesifikk knokkel kan beskrives som kraft per flateenhet, noe som fører til en «stress – strain» respons. Denne avhenger igjen av flere faktorer som retningen av belastning, beinets form og mikroarkitektur, beintetthet, og påvirkning fra omkringliggende muskler.
Når en knokkel utsettes for belastning, oppstår det deformasjonskrefter. Hvis kraften som påvirker beinet er innenfor beinets elastiske grense, vil beinet returnere til sin opprinnelige form og posisjon etter at kraften er fjernet. Belastninger som overskrider denne grensen, fører beinet inn i en plastisk sone hvor irreversible endringer og dannelsen av mikrosprekker kan oppstå.1
Beinets respons på fysisk belastning varierer også avhengig av beintype. Kortikalt bein har høy elastisitetsmodus, svært god evne til å motstå kompresjonskrefter, men er mer utsatt for bøyingskrefter. Disse bøyingskreftene som blant annet oppstår under løping, er antatt å være en viktig faktor i utviklingen av stressreaksjoner i lange ben. Trabekulært bein har gode evner til å motstå bøyingskrefter, men er mer følsomt overfor kompresjonskrefter.1
Denne forståelsen er avgjørende for å forstå hvordan ulike typer fysisk belastning påvirker skjelettet og remodelleringen.
Mikroskader
Dannelsen av mikroskader, eller mikrosprekker, i beinvev antas å være en konsekvens av en gradvis nedgang i stivheten, noe som selv stammer fra mikroskader i matrixens forskjellige deler.
Ved gjentatte påkjenninger utvikles det diffuse, fokale områder med et nettverk av ultra-strukturelle mikrosprekker på tensjonssiden av beinet samt lineære mikrosprekker både interstitielt og inne i osteonene på kompresjonssiden.3
Dersom belastningen på beinet kontinuerlig belastes utover dets kapasitet for reparasjon, kan det oppstå en prosess hvor beinets stivhet gradvis reduseres ytterligere. Dette scenarioet kan føre til en videreutvikling av mikroskader som med tiden kan eskalere til en stressreaksjon i beinvevet.
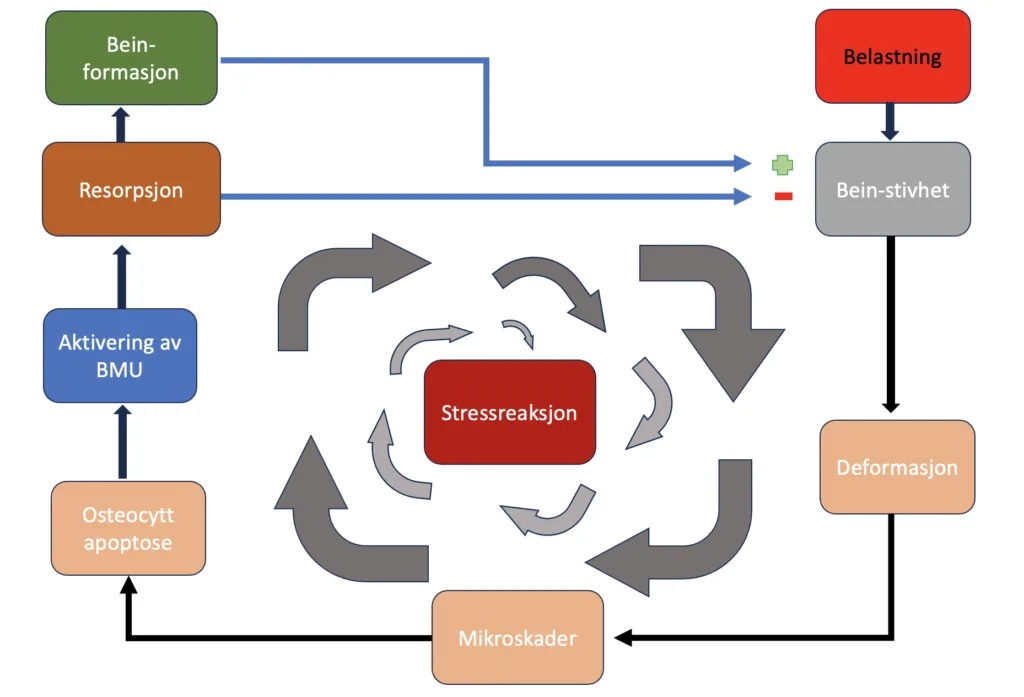
Remodelleringsprosessen
Beinvev i menneskekroppen er under stadig fornyelse gjennom remodelleringsprosessen, hvor skadet og aldrende beinvev erstattes med nytt bein. Denne prosessen utføres hovedsakelig av to typer celler: osteoklaster, som bryter ned bein, og osteoblaster, som bygger opp nytt bein.
Remodellering av kortikalt bein
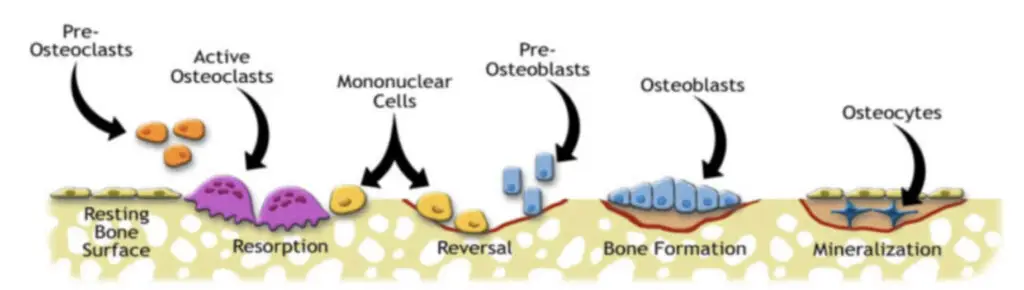
Mikrosprekker i beinet fører til skade på canaliculi, de små kanalene som tillater kommunikasjon mellom osteocyttene. Dette fører til apoptose (programmert celledød) av cellen, noe som igjen aktiverer celler som danner midlertidige strukturer kjent som basale multiceullære enheter (BMU). Disse enhetene beveger seg langs lengden av diafysen i beinet, og opprettholder en unik tredimensjonal struktur.
Osteoklaster leder an i BMU-prosessen ved først å resorbere beinvev. De skaper et isolert miljø under seg selv og løser opp beinets mineraler med syre. Deretter bruker de enzymer for å bryte ned den organiske matrixen. Denne prosessen når sitt høydepunkt etter omtrent tre uker, og etterlater hulrom der mikrosprekkene var, noe som gir en midlertidig svekkelse av beinet.5,10
I fasen som følger, kjent som reverseringsfasen, inntar en gruppe mononukleære celler området for å utjevne overflaten som en forberedelse til dannelsen av en reverseringslinje – et lag med umineralisert matrix.
Til slutt inntar osteoblaster området. De fester seg til reverseringssonen, og begynner produksjonen av en osteoid matrix rik på type 1 kollagen, som gradvis mineraliseres. Noen av disse osteoblastene blir fanget i matrixen og omdannes til osteocytter. Ettersom flere lameller av osteonalt bein legges ned og mineraliseres, reduseres størrelsen på remodelleringsområdet. Når prosessen er ferdig, har det blitt dannet nye osteoner med en ny Haversk kanal. Det tar omtrent 90 dager for å fylle resorpsjonskavitetene med lamellært bein.2,5,6,7,8
Da deponering av nytt bein kommer etter dannelsen av resorpsjonskavitetene er beinet relativt svekket i denne perioden. Dersom belastningen fortsetter, vil osteoklastisk resorpsjon dominere. Dette vil føre til akkumulering av mikroskade og tilstanden vil kunne utvikle seg til en stressreaksjon.1
Remodellering av trabekulært bein
Remodelleringsprosessen i trabekulært bein skiller seg noe fra den i kortikalt bein ved at den ikke involverer dannelsen og utfyllingen av langsgående kanaler. I stedet fokuserer prosessen på fjerning og erstatning av mer sirkulært definerte områder i det trabekulære beinvevet.
Denne spesifikke remodelleringsdynamikken tillater trabekulært bein å tilpasse seg og omorganisere trabeklene, slik at strukturen blir optimalisert for å motstå de belastningene den eksponeres for. Dette sørger for at trabekulært bein opprettholder sin evne til effektivt å absorbere og fordele belastninger, noe som er avgjørende for både beinets styrke og funksjonalitet.1,2
Remodelleringsprosessen og tidsaspekt
Hele remodelleringsprosessen kan ta fra 2-8 måneder. Tiden denne prosessen tar er blant annet avhengig av hvor mange BMUer som dannes. Dette kalles aktiveringsfrekvens. Høy aktiveringsfrekvens vil resultere i et stort antall aktive BMUer, som igjen fører til et stort antall sekundære osteoner.2
En annen faktor er hvor raskt BMUen beveger seg over vevet. Dette kalles Sigma perioden. Sigma perioden kvantifiserer antall dager det tar BMUen å gjøre en komplett remodellering av et spesifikt område i beinet. Sigma perioden deles inn i resorpsjon- og formasjonsperioder.2
Studier har vist at det vanligvis tar omtrent 120 dager for BMUen å resorbere bein og lage et nytt ferdig formet osteon i kortikalt bein. Resorpsjonen tar omtrent 20 dager, etterfulgt av 10 dager med reversering, og til slutt omtrent 90 dager med formasjon av nytt bein.2
Metabolske beinsykdommer manifesterer seg i en eller annen form for forstyrrelse i BMUens dynamikk, og mange sykdommer klassifiseres ut fra dens effekt på aktiverings frekvensen og sigma perioden.2
Remodellering og beinbalanse
Remodellering av bein foregår gjennom en nøye koordinert prosess hvor osteoklaster, som bryter ned bein, etterfølges av osteoblaster, som danner nytt bein. Denne sekvensielle aktiviteten, hvor hele enheten beveger seg som en koordinert anatomisk struktur, bidrar til at nytt bein dannes der gammelt bein har blitt resorbert. Dette sikrer at totalt beinvolum og struktur forblir stabilt over tid, en prosess omtalt som «koblet» remodellering. Nettoresultatet av bein som fjernes og erstattes, er kjent som beinbalansen.6 Selv om denne prosessen vanligvis er stabil, kan beinbalansen bli forstyrret av ulike sykdommer eller tilstander, slik som ved osteoporose, hvor det er en netto negativ beinbalanse med mer beinresorpsjon enn beindannelse. Ved avlasting vil også turnover i bein øke, og det oppstår en negativ beinbalanse. Resorpsjon av bein øker, og fører til raskt tap av beinmasse.2
Bein modellering
Ved siden av remodelleringsprosessen skjer det også bein-modellering. Dette er en prosess som fører til økning av beinmasse. I motsetning til remodellering, hvor det er en balanse mellom nedbrytning og nydannelse, arbeider osteoklaster og osteoblaster på forskjellige flater under modellering.

Dette fører til en nettoøkning i beinmasse og styrke, da osteoklaster resorberer mindre bein enn det osteoblastene deponerer. Dette bidrar til økt knokkelstyrke og diameter, og gjør modellering til en effektiv prosess for å endre formen og massen på knoklene.9,10 Når for eksempel bekkenet vokser i størrelse, skjer dette gjennom modellering.
Referanser:
1 Lefere, M., Demeyere, A. & Vanhoenacker, F. in Imaging of Orthopedic Sports Injuries (eds Filip M. Vanhoenacker, Mario Maas, & Jan L. M. A. Gielen) 135-150 (Springer International Publishing, 2021).
2 Robling, A. G., Castillo, A. B. & Turner, C. H. Biomechanical and molecular regulation of bone remodeling. Annual review of biomedical engineering 8, 455-498, doi:10.1146/annurev.bioeng.8.061505.095721 (2006).
3 Boyce, T. M., Fyhrie, D. P., Glotkowski, M. C., Radin, E. L. & Schaffler, M. B. Damage type and strain mode associations in human compact bone bending fatigue. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 16, 322-329, doi:10.1002/jor.1100160308 (1998).
4 Hughes, J. M., Popp, K. L., Yanovich, R., Bouxsein, M. L. & Matheny, R. W., Jr. The role of adaptive bone formation in the etiology of stress fracture. Exp Biol Med (Maywood) 242, 897-906, doi:10.1177/1535370216661646 (2017).
5 Xiao, W., Wang, Y., Pacios, S., Li, S. & Graves, D. T. Cellular and Molecular Aspects of Bone Remodeling. Frontiers of oral biology 18, 9-16, doi:10.1159/000351895 (2016).
6 Kenkre, J. S. & Bassett, J. The bone remodelling cycle. Annals of clinical biochemistry 55, 308-327, doi:10.1177/0004563218759371 (2018).
7 Romani, W. A., Gieck, J. H., Perrin, D. H., Saliba, E. N. & Kahler, D. M. Mechanisms and management of stress fractures in physically active persons. Journal of athletic training 37, 306-314 (2002).
8 Campbell, S. E. & Fajardo, R. S. Imaging of stress injuries of the pelvis. Seminars in musculoskeletal radiology 12, 62-71, doi:10.1055/s-2008-1067938 (2008).
9 Rauch, F. Watching bone cells at work: what we can see from bone biopsies. Pediatr Nephrol 21, 457-462, doi:10.1007/s00467-006-0025-6 (2006).
10 Yusof, N. A., Soames, R. W., Cunningham, C. A. & Black, S. M. Growth of the human ilium: the anomalous sacroiliac junction. Anatomical record 296, 1688-1694, doi:10.1002/ar.22785 (2013).